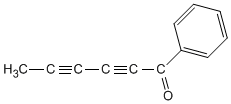martes, 13 de mayo de 2014
Propiedades das reacións de polimerización
PROPIEDADES
Propiedades eléctricas
Para evitar cargas estáticas en aplicacións que o requiran, xeneralizouse o uso de antiestáticos que permite na superficie do polímero unha condución parcial de cargas eléctricas.
Evidentemente a principal desventaja dos materiais plásticos nestas aplicacións está en relación á perda de características mecánicas e geométricas coa temperatura. Con todo, xa se dispón de materiais que resisten sen problemas temperaturas relativamente elevadas (superiores aos 200 °C).
As propiedades eléctricas dos polímeros industriais están determinadas principalmente, pola natureza química do material (enlaces covalentes de maior ou menor polaridad) e son pouco sensibles á microestructura cristalina ou amorfa do material, que afecta moito máis ás propiedades mecánicas. O seu estudo se acomete mediante ensaios de comportamento en campos eléctricos de distinta intensidade e frecuencia. Seguidamente analízanse as características eléctricas destes materiais.
Propiedades físicas dos polímeros.
Estudos de difracción de raios X sobre mostras de polietileno comercial, mostran que este material, constituído por moléculas que poden conter desde 1.000 ata 150.000 grupos CH2 - CH2 presentan rexións cun certo ordenamiento cristalino, e outras onde se evidencia un carácter amorfo: a estas últimas considéraselles defectos do cristal. Neste caso as forzas responsables do ordenamiento cuasicristalino, son as chamadas forzas de van der Waals. Noutros casos (nylon 66) a responsabilidade do ordenamiento recae en enlácelos de H.
A temperatura ten moita importancia en relación ao comportamento dos polímeros. A temperaturas máis baixas os polímeros vólvense máis duros e con certas características vítreas, debido á perda de movemento relativo entre as cadeas que forman o material. A temperatura á que funden as zonas cristalinas chámase temperatura de fusión (Tf). Outra temperatura importante é a de descomposición e é conveniente que sexa bastante superior a Tf.
A temperatura ten moita importancia en relación ao comportamento dos polímeros. A temperaturas máis baixas os polímeros vólvense máis duros e con certas características vítreas, debido á perda de movemento relativo entre as cadeas que forman o material. A temperatura á que funden as zonas cristalinas chámase temperatura de fusión (Tf). Outra temperatura importante é a de descomposición e é conveniente que sexa bastante superior a Tf.
Son unha consecuencia directa da súa composición, así como da estrutura molecular, tanto a nivel molecular como supermolecular. Actualmente as propiedades mecánicas de interese son as dos materiais polímeros e estas han de ser melloradas mediante a modificación da composición ou morfología: por exemplo, cambiar a temperatura á que os polímeros se ablandan e recuperan o estado de sólido elástico ou tamén o grado global da orde tridimensional. Normalmente o incentivo de estudos sobre as propiedades mecánicas é generalmente debido á necesidade de correlacionar a resposta de diferentes materiais baixo un rango de condicións con obxecto de predecir o comportamento destes polímeros en aplicacións prácticas.
Durante moito tempo os ensaios foron realizados para comprender o comportamento mecánico dos materiais plásticos a través da deformación da rede de polímeros reticulados e cadeas moleculares enredadas, pero os esforzos para describir a deformación doutros polímeros sólidos en términos de procesos operando a escala molecular son máis recentes. Polo tanto, consideraranse os diferentes tipos de resposta mostrados polos polímeros sólidos a diferentes niveis de tensión aplicados; elasticidad, viscoelasticidad, fluxo plástico e fractura.
QUÍMICA E INDUSTRIA
REACIÓN DE POLIMERIZACIÓN
Os polímeros (do Grego: poly: moitos e mero: parte, segmento) son macromoléculas (generalmente orgánicas) formadas pola unión de moléculas máis pequenas chamadas monómeros.
O almidón, a celulosa, a seda e o ADN son exemplos de polímeros naturais, entre os máis comúns destes e entre os polímeros sintéticos atopamos o nailon, o polietileno e a baquelita.
- Tipos de polimerización
Existen dous tipos fundamentais de polimerización:
- Polimerización por condensación.
Os Homopolímeros.
Polietilenglicol
Siliconas
Os Copolímeros.
Baquelitas.
Poliésteres.
Poliamidas.
A polimerización en etapas (condensación) necesita polo menos monómeros bifuncionales. Deben de saber que os polímeros poden ser maquinables.
Exemplo: HOOC--R1--NH2
Si reacciona consigo mesmo, entón:
2 HOOC--R1--NH2 <----> HOOC--R1--NH· ·OC--R1--NH2 H2Ou <----> HOOC--R1-NH--CO--R1--NH2 H2Ou
- Polimerización por adición.
Adoitan seguir un mecanismo en tres fases, con ruptura hemolítica:
Iniciación: CH2=CHCl catalizador •CH2–CHCl•
Propagación ou crecemento: 2 •CH2–CHCl• ⇒ •CH2–CHCl–CH2–CHCl•
Terminación: Os radicais libres dos extremos únense a impurezas ou ben se unen dúas cadeas cun terminal neutralizado.
PH, Medida de acidez
O pH é unha medida de acidez ou alcalinidad dunha disolución. O pH indica a concentración de iones hidronio [H3Ou ] presentes en determinadas sustancias.
A sigla significa ''potencial hidróxeno'', ''potencial de hidróxeno'' ou ''potencial de hidrogeniones''
En disolución acuosa, a escala de pH varía, típicamente, de 0 a 14. Son acedas as disoluciones con pH menores que 7 (o valor do exponente da concentración é maior, porque hai máis iones na disolución) e alcalinas as de pH superiores a 7. Si o disolvente é auga, o pH = 7 indica neutralidad da disolución.
En produtos de aseo e limpeza adóitase usar a expresión "pH neutro". Neste caso a neutralidad fai referencia a un nivel de pH 5,5. Debido ás características da pel humana, cuxo pH é 5,5, indícase neutralidad de pH neste tipo de produtos que están destinados a entrar en contacto coa pel para destacar a súa non agresividade. Si aplicásense produtos de pH 7 á pel produciríase unha variación do pH cutáneo con posibles consecuencias negativas.
O valor do pH pódese medir de forma precisa mediante un potenciómetro, tamén coñecido como pH-metro (/pe achímetro/ ou /pe ache metro/), un instrumento que mide a diferenza de potencial entre dous electrodos: un electrodo de referencia (generalmente de prata/cloruro de prata) e un electrodo de vidro que é sensible ao ion de hidróxeno.
O pH dunha disolución pódese medir tamén de xeito aproximado empregando indicadores: ácidos ou bases débiles que presentan diferente cor segundo o pH. Generalmente emprégase papel indicador, que consiste en papel impregnado cunha mestura de indicadores cualitativos para a determinación do pH. O indicador máis coñecido é o papel de litmus ou papel tornasol. Outros indicadores usuais son a fenolftaleína e o laranxa de metilo.
Malia que moitos potenciómetros teñen escalas con valores que van desde 1 ata 14, os valores de pH tamén poden ser aínda menores que 1 ou aínda maiores que 14. Por exemplo o ácido de batería de automóbiles ten valores próximos de pH menores que uno. Por contraste, o hidróxido de sodio 1 M varía de 13,5 a 14.
A 25 °C, un pH igual a 7 é neutro, un menor que 7 é acedo, e si é maior que 7 é básico. A distintas temperaturas, o valor de pH neutro pode variar debido á constante de equilibrio do auga (kw).
A sigla significa ''potencial hidróxeno'', ''potencial de hidróxeno'' ou ''potencial de hidrogeniones''
En disolución acuosa, a escala de pH varía, típicamente, de 0 a 14. Son acedas as disoluciones con pH menores que 7 (o valor do exponente da concentración é maior, porque hai máis iones na disolución) e alcalinas as de pH superiores a 7. Si o disolvente é auga, o pH = 7 indica neutralidad da disolución.
En produtos de aseo e limpeza adóitase usar a expresión "pH neutro". Neste caso a neutralidad fai referencia a un nivel de pH 5,5. Debido ás características da pel humana, cuxo pH é 5,5, indícase neutralidad de pH neste tipo de produtos que están destinados a entrar en contacto coa pel para destacar a súa non agresividade. Si aplicásense produtos de pH 7 á pel produciríase unha variación do pH cutáneo con posibles consecuencias negativas.
O pH dunha disolución pódese medir tamén de xeito aproximado empregando indicadores: ácidos ou bases débiles que presentan diferente cor segundo o pH. Generalmente emprégase papel indicador, que consiste en papel impregnado cunha mestura de indicadores cualitativos para a determinación do pH. O indicador máis coñecido é o papel de litmus ou papel tornasol. Outros indicadores usuais son a fenolftaleína e o laranxa de metilo.
Malia que moitos potenciómetros teñen escalas con valores que van desde 1 ata 14, os valores de pH tamén poden ser aínda menores que 1 ou aínda maiores que 14. Por exemplo o ácido de batería de automóbiles ten valores próximos de pH menores que uno. Por contraste, o hidróxido de sodio 1 M varía de 13,5 a 14.
A 25 °C, un pH igual a 7 é neutro, un menor que 7 é acedo, e si é maior que 7 é básico. A distintas temperaturas, o valor de pH neutro pode variar debido á constante de equilibrio do auga (kw).
Pila


Podemos observar na fotografia 1 o que acontece nunha pila sen embargo na fotografia 2 observamos que non existe reación, Porque? Pois porque non existe unha ponte salina ou tubo en U que conecte ambolos dous basos, polo que non existe ningun proceso. Esta ponte salina ten que estar empapada de un líquido polo que non pasen electróns, ou se falamos dun tubo de U, ambos extremos terían que ser tapados con bolas de algodón.
PILAS, PRÁTICA
PILAS, PILA GALVANICA OU PILA DANIEL
No referido as pilas...
O que vos explica neste video é o proceso de como é unha pila.
Cando os electrodos reaccionan co electrolito, nun dos electrodos (o ánodo) prodúcense electróns (oxidación), e no outro (cátodo) prodúcese un defecto de electróns (redución). Cando os electróns sobrantes do ánodo pasan ao cátodo a través dun condutor externo á pila prodúcese unha corrente eléctrica.
Cando os electrodos reaccionan co electrolito, nun dos electrodos (o ánodo) prodúcense electróns (oxidación), e no outro (cátodo) prodúcese un defecto de electróns (redución). Cando os electróns sobrantes do ánodo pasan ao cátodo a través dun condutor externo á pila prodúcese unha corrente eléctrica.
Factores que influen no equilibrio químico
Factores que modifican o equilibrio. Lei de Le Chatelier.
Existen diversos factores capaces de modificar o estado de equilibrio dun proceso químico como son a temperatura, a presión e o efecto das concentracións.
Si nun sistema en equilibrio modifícase algún dos factores que inflúen no mesmo (temperatura, presión ou concentración), o sistema evoluciona de forma que se despraza no sentido que tenda a contrarrestar dita variación.
Existen diversos factores capaces de modificar o estado de equilibrio dun proceso químico como son a temperatura, a presión e o efecto das concentracións.
Si nun sistema en equilibrio modifícase algún dos factores que inflúen no mesmo (temperatura, presión ou concentración), o sistema evoluciona de forma que se despraza no sentido que tenda a contrarrestar dita variación.
- Efecto da temperatura.
- Efecto da presión.
- Efecto das concentracións.
EQUILIBRIO QUÍMICO
Relación entre as constantes de equilibrio
Kc = Kp.(RT) n
Si Kc ten un valor alto, a reacción química desprázase cara aos produtos.
Si Kc ten un valor baixo, a evolución do equilibrio foi desfavorable para os produtos.
Relación entre as constantes de equilibrio e o grado de disociación
Unha das grandes aplicacións da lei de equilibrio químico é, precisamente, o cálculo do rendemento dunha reacción química, é dicir, o grado de desprazamento do equilibrio cara aos produtos, coñecida a Kc.
O grado de disociación en tanto por un dun proceso químico defínese como:
O cociente entre o número de moles disociados dividido polo número total de moles iniciais.
Número de moles ou moléculas disociados ou perdidos
Número de moles ou moléculas iniciais
Multiplicando o cociente anterior por 100 obteriamos o grado de disociación expresado en tanto por cento, o cal daría unha idea da evolución do equilibrio. Os seus valores oscilarán entre 0 e 1.
Kc = Kp.(RT) n
Si Kc ten un valor alto, a reacción química desprázase cara aos produtos.
Si Kc ten un valor baixo, a evolución do equilibrio foi desfavorable para os produtos.
Relación entre as constantes de equilibrio e o grado de disociación
Unha das grandes aplicacións da lei de equilibrio químico é, precisamente, o cálculo do rendemento dunha reacción química, é dicir, o grado de desprazamento do equilibrio cara aos produtos, coñecida a Kc.
O grado de disociación en tanto por un dun proceso químico defínese como:
O cociente entre o número de moles disociados dividido polo número total de moles iniciais.
Número de moles ou moléculas disociados ou perdidos
Número de moles ou moléculas iniciais
Multiplicando o cociente anterior por 100 obteriamos o grado de disociación expresado en tanto por cento, o cal daría unha idea da evolución do equilibrio. Os seus valores oscilarán entre 0 e 1.
viernes, 9 de mayo de 2014
Exercicios equilibrio químico
1.- Nun recipiente inicialmente baleiro, introdúcense dous gases A e B á presión parcial de 1 atm. e 100 ºC. Mantendo a temperatura e a presión constantes, prodúcese a seguinte reacción:
A(g) 2 B(g) <--> 2 C(g) D(s)
Cando se alcanza o equilibrio o grado de disociación é de 0.25. Calcular as constantes Kc e Kp así como as presións parciais de A, B e C.
2.- Atopouse que cando a reacción:
3 NON2 H2Ou <--> 2 HNO3 NON
chega ao equilibrio a 300ºC contén 0.60 moles de dióxido de nitrógeno, 0.40 moles de auga, 0.60 moles de ácido nítrico e 0.80 moles de óxido nítrico. Calcular cantos moles de acedo nítrico deben engadirse ao sistema para que a cantidade final de dióxido de nitrógeno sexa de 0.90 moles. O volume do recipiente é de 1.00L.
3.- A formación do trióxido de azufre por oxidación do dióxido é un paso intermedio na fabricación do ácido sulfúrico. A constante de equilibrio (Kp) da reacción:
2 SO2(g) Ou2(g) <--> 2 SO3(g)
é 0.13 a 830ºC. Nun experimento fanse reaccionar 2.00 moles de dióxido de azufre con 2.00 moles de osíxeno. Cúal debe ser a presión total de equilibrio para ter un rendemento do 70% en trióxido de azufre?
4.- A 300ºC e unha presión total de 629 atm. a reacción entre o cloruro de hidrógeno e o osíxeno para dar cloro e auga, alcanza o equilibrio cando se completou nun 80%. Cal tería que ser a presión para que a reacción alcanzase o equilibrio cando se completou nun 50%?
5.- Un recipiente de 1.00L énchese cunha mestura en volumenes iguais de osíxeno e dióxido de nitrógeno a 27ºC e 673 mm Hg de presión parcial. Quéntase a 420ºC e unha vez alcanzado o equilibrio atópanse 0.0404 moles de osíxeno. Calcular a constante de equilibrio para o proceso
2NON(g) Ou2(g) <--> 2 NON2(g)
e a presión total da mestura.
6.- A constante Kp para a reacción entre o dióxido de carbono puro e o grafito, en exceso, quente é 10. Calcular: a) Cal é a composición en volume dos gases en equilibrio a 817ºC e unha presión total de 6,1 atm? cal é a presión parcial do dióxido de carbono? e b) Para que presión obterase un 10% en volume de dióxido de carbono?
CO2(g) C(s) <--> 2 CO(g)
Estes exercicios foron empregados de esta paxina web: http://www.personales.ulpgc.es/cling.dip/prob9.html
jueves, 8 de mayo de 2014
miércoles, 7 de mayo de 2014
EQUILIBRIO QUÍMICO
Reacións directas e inversas :
A existenza simultanea da reación directe e da inversa acostumase a representar por unha doble frecha entre os reactivos e productos:
reación directa
reacion inversa
Cando a velocidade da reación directa e da reación inversa igualanse, a reación non mostra, aparentemente, ningunha variación. Dise que a reación chegou o equilibrio.
Esta igualdade das velocidades directa e inversa chamase a constante de equilibrio, Ke, .
A existenza simultanea da reación directe e da inversa acostumase a representar por unha doble frecha entre os reactivos e productos:
reación directa
reacion inversa
Cando a velocidade da reación directa e da reación inversa igualanse, a reación non mostra, aparentemente, ningunha variación. Dise que a reación chegou o equilibrio.
Esta igualdade das velocidades directa e inversa chamase a constante de equilibrio, Ke, .
TERMODINÁMICA II
Condición de equilibrio e espontaneidade:
A variación da función do traballo, ΔA, e especialmente a variación da enerxía libre, ΔG, proporcionan criterios cómodos para saber se unha reacción, ou un proceso en xeral, está en equilibrio ou é espontaneo. Pódese resumir como:
REACIÓN T e P constante T e V constante
Equilibrio ΔG = 0 ΔA = 0
Espontaneo ΔG < 0 ΔA < 0
Non espontaneo ΔG > 0 ΔA > 0
outra tabla é:
ΔA ΔS ΔG Espontaneidade da reación ( ΔG = ΔH - ΔS )
+ - + A reación química nunca é espontanea.
- + - A reación sempre é espontanea.
+ + +/- Depende da temperatura: si | ΔH | < | T ΔS |, será espontanea.
- - -/+ Depende da temperatura: si | ΔH | > | T ΔS |, será espontanea.
Enerxía libre de Gibbs :
G = H - TS
Enerxía libre de Hemboltz :
A = U - TS
Entalpía dos enlaces :
ΔH reacción = ∑ H enlaces rotos - ∑ H enlaces formados
NOTA : En condicións estándar presión = 1 atm e a temperatura = 298 , 16 k ( grados kelvin) ou 25ºC (grados centígrados).
A variación da función do traballo, ΔA, e especialmente a variación da enerxía libre, ΔG, proporcionan criterios cómodos para saber se unha reacción, ou un proceso en xeral, está en equilibrio ou é espontaneo. Pódese resumir como:
REACIÓN T e P constante T e V constante
Equilibrio ΔG = 0 ΔA = 0
Espontaneo ΔG < 0 ΔA < 0
Non espontaneo ΔG > 0 ΔA > 0
outra tabla é:
ΔA ΔS ΔG Espontaneidade da reación ( ΔG = ΔH - ΔS )
+ - + A reación química nunca é espontanea.
- + - A reación sempre é espontanea.
+ + +/- Depende da temperatura: si | ΔH | < | T ΔS |, será espontanea.
- - -/+ Depende da temperatura: si | ΔH | > | T ΔS |, será espontanea.
Enerxía libre de Gibbs :
G = H - TS
Enerxía libre de Hemboltz :
A = U - TS
Entalpía dos enlaces :
ΔH reacción = ∑ H enlaces rotos - ∑ H enlaces formados
NOTA : En condicións estándar presión = 1 atm e a temperatura = 298 , 16 k ( grados kelvin) ou 25ºC (grados centígrados).
TERMODINÁMICA I
Entalpía de formación
Entalpía de enlace
Unha reacción química consiste na formación de novas sustancias (produtos) a partir doutras (reactivos). Neste proceso rómpense enlaces dos reactivos e fórmanse outros novos nos produtos.
A enerxía (ou entalpía) de enlace é a enerxía necesaria para romper un mol de enlaces dunha sustancia en estado gaseoso. No caso de moléculas diatómicas cun só enlace, correspóndese coa enerxía necesaria para disociar 1 mol de devandita sustancia nos átomos que a forman. Para moléculas poliatómicas, a enerxía de enlace tómase como o valor medio necesario para romper cada un dos enláces iguais.
En química e en física usamos moitas magnitudes son relativas, é dicir o seu valor depende do punto de referencia escolleito. Algunhas destas magnitudes son a posición, a velocidade, a enerxía cinética, a enerxía potencial... Con todo, as súas variacións dunha situación a outra si que teñen un valor determinado (independientemente do punto de referencia escolleito). Cando falamos da entalpía ou da enerxía interna, atopámosnos/atopámonos ante unha situación parecida: non é posible coñecer o valor absoluto da entalpía ΔH, pero si que podemos determinar o valor dos seus cambios ΔH. É posible, xa que logo, escoller arbitrariamente unha orixe para estas magnitudes e a partir de aí traballar coas súas variacións.
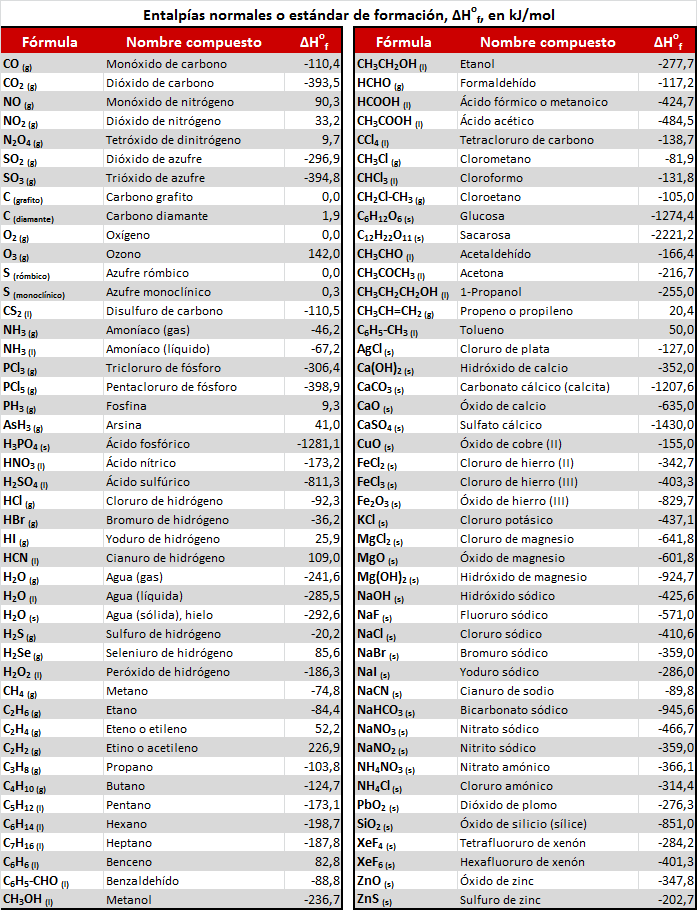
Para cada composto definiremos como entalpía normal de formación ΔHfº á variación de entalpía que se produce cando se forma (en condicións normais) un mol de sustancia a partir dos seus elementos constituyentes.
Consideraremos (arbitrariamente) que os elementos no seu estado habitual en condicións normais teñen entalpía de formación nula. Esta consideración permítenos construír unha táboa de entalpías de formación estándar (ou normal) para os diferentes compostos.
Consideraremos (arbitrariamente) que os elementos no seu estado habitual en condicións normais teñen entalpía de formación nula. Esta consideración permítenos construír unha táboa de entalpías de formación estándar (ou normal) para os diferentes compostos.
Entalpía de enlace
Unha reacción química consiste na formación de novas sustancias (produtos) a partir doutras (reactivos). Neste proceso rómpense enlaces dos reactivos e fórmanse outros novos nos produtos.
A enerxía (ou entalpía) de enlace é a enerxía necesaria para romper un mol de enlaces dunha sustancia en estado gaseoso. No caso de moléculas diatómicas cun só enlace, correspóndese coa enerxía necesaria para disociar 1 mol de devandita sustancia nos átomos que a forman. Para moléculas poliatómicas, a enerxía de enlace tómase como o valor medio necesario para romper cada un dos enláces iguais.
Tabla de entalpías estándar de formación :

TERMODINÁMICA
Que é a termodinámica?
A termodinámica é a parte da ciencia que estuda os intercambios de enerxía asociados aos procesos físicos e aos químicos (reaccións). Unha reacción pode liberar ou absorber enerxía, e un cambio físico pode facer o mesmo.
A termoquímica céntrase nos intercambios de enerxía entre o sistema en estudo e a súa contorna. A termoquímica é útil para predecir a evolución dun sistema segundo a enerxía intercambiada en combinación coas determinaciones da entropía, que tamén se utiliza para predecir si unha reacción é espontánea ou non espontánea. As reaccións endotérmicas absorben calor. As reaccións exotérmicas liberan calor. A termoquímica funde os conceptos da termodinámica co concepto de enerxía en forma de enlaces químicos. Isto inclúe o cálculo de magnitudes tales como a capacidade calorífica, a
calor da combustión, a entalpía, a entropía, a enerxía libre...
En termodinámica clasificamos os sistemas como:
- Sistemas illados. Son os que non intercambian nin materia nin enerxía coa contorna. Xa que logo, a cantidade total de masa e de enerxía permanece constante.
- Sistemas pechados. Son aqueles que non poden intercambiar masa pero si enerxía. A cantidade total de enerxía do sistema variará.
- Sistemas abertos. Nestes intercámbiase materia e enerxía co exterior.
Entalpía de reacción.
Xa vimos que a calor absorbida ou desprendida a presión constante nun proceso chámase (variación de) entalpía.Esta variación de entalpía podémola escribir como ΔH, si temos en conta o primeiro principio da termodinámica para un gas ideal:
ΔU = ΔH + W = ΔH - PΔV
reordenando:
ΔH = ΔU + P·ΔV
podemos definir a entalpía absoluta como: H = U + P·V
En concreto, si esta calor é desprendido ou absorbido nunha reacción química recibe o nome
de entalpía de reacción e simbolizámolo como ΔHr.
Unha reacción chámase exotérmica si o seu entalpía de reacción é negativa (é dicir, si o sistema
cede calor) e endotérmica si o seu entalpía é positiva (é dicir, si o sistema absorbe calor).
Entalpía normal de reacción.
A variación da entalpía normal ou estándar (denotada como ΔHºr)
é a variación de entalpía que se dá nun sistema durante unha reacción química baixo condicións normais (P = 1 atm, T = 25 ºC). A súa unidade é o J (Julio) no sistema internacional de unidades (aínda que é máis habitual atopala expresada en kJ (kilojulio) ).
miércoles, 26 de marzo de 2014
As partículas atmosféricas máis pequenas repercuten no desenvolvemento embrionario
Un traballo dirixido por investigadores do Consello Superior de Investigacións Científicas (CSIC) ha evaluado o efecto negativo sobre o metabolismo das partículas atmosféricas de diámetro menor que un micrómetro, tamén denominadas submicrónicas (PM1). Segundo o estudo estas partículas son tan pequenas que poden atravesar os alveolos pulmonares e entrar no torrente sanguíneo.Un traballo dirixido por investigadores do Consello Superior de Investigacións Científicas (CSIC) ha evaluado o efecto negativo sobre o metabolismo das partículas atmosféricas de diámetro menor que un micrómetro, tamén denominadas submicrónicas (PM1). Segundo o estudo estas partículas son tan pequenas que poden atravesar os alveolos pulmonares e entrar no torrente sanguíneo.
"Os resultados mostran que estas partículas provocan malformaciones nos embriones e insuficiencia cardiaca, efectos que concuerdan cos estudos epidemiológicos realizados ata a data. Ademais, demostran que as partículas máis pequenas teñen efectos perniciosos comparables ou superiores ás partículas contaminantes de maior tamaño. Isto reforza a idea de que se necesita un control máis estrito sobre a contaminación por partículas pequenas", explica o investigador do CSIC Benjamí Piña, do Instituto de Diagnóstico Ambiental e Estudos do Auga.
Actualmente, a lexislación establece límites á contaminación por partículas tomando como referencia as partículas maiores (as PM10), e establece un tope de masa de partículas por metro cúbico de aire. Con todo, sinala o estudo, en comparación coas PM10, as partículas PM1 teñen mil veces menos masa, menos contido mineral e moita máis materia orgánica nociva, fundamentalmente hidrocarburos aromáticos policíclicos (PAH) e outros compostos tipo dioxina.
"Esta combinación dun menor tamaño e unha maior concentración de substancias nocivas fai necesario un control máis estrito das PM1. Por exemplo, os motores dos coches están preparados para expulsar partículas cada vez máis pequenas e de menor masa, pero que a pesar do menor tamaño poden ter máis compostos orgánicos daniños".
http://www.quimica.es/noticias/147288/las-particulas-atmosfericas-mas-pequenas-repercuten-en-el-desarrollo-embrionario.html
Investigadores do CSIC describen o comportamento de nanoespumas de silicio
Unha investigación na que participou o Consello Superior de Investigacións Científicas (CSIC) descubriu que as estruturas tipo espumas de tamaño nanométrico seguen as mesmas leis universais que a espuma de jabón: as burbullas (estruturas) pequenas van desaparecendo a favor das grandes. Os investigadores chegaron a esta conclusión tras producir e caracterizar unha nanoespuma sobre unha superficie de silicio mediante irradiación con iones energéticos. Este estudo describe a evolución destas nanoestructuras ao longo do tempo de irradiación.
"Os resultados deste traballo axúdannos a entender como evolucionan certos sistemas materiais ante a presenza dun axente externo, como é neste caso a irradiación iónica. Ademais, teñen un interese práctico, tanto pola importancia das aplicacións tecnolóxicas do silicio, como polas dimensións nanométricas nas que se desenvolve o fenómeno", explica o investigador do CSIC Luís Vázquez, do Instituto de Ciencia de Materiais de Madrid.
Dinámica das nanoespumas
Nas estruturas tipo espuma as variacións en torno a un motivo básico, como unha burbulla de jabón illada, repítense de xeito máis ou menos ordenado ata reencher completamente unha rexión bidimensional ou tridimensional. Exemplos deste fenómeno poden observarse nas demarcaciones xeográficas, nas formas presentes na pel de certos animais (como nas jirafas), na espuma da cervexa e nos materiais policristalinos, entre moitos outros.
Segundo este estudo, a interacción entre as nanoburbujas determina en promedio como crece cada unha delas. Desta forma, é posible obter información geométrica sobre unha estrutura a partir do tipo de orde que representa e da súa evolución temporal, como xa ocorre coas espumas macroscópicas mencionadas anteriormente. Este achado foi posible grazas a unha ecuación, que tamén se aplica noutros sistemas, que describe as observacións experimentais con precisión. A validez desta fórmula neste estudo implica que a formación de certos patróns auto organizados e a dinámica das espumas serían manifestacións distintas dun mesmo principio.
Publicación orixinal:
Mario Castro, Rodolfo Cuerno, M. Mar García-Hernández e Luis Vázquez; "Pattern-wavelength coarsening from topological dynamics in silicon nanofoams."; Physical Review Letters.
viernes, 21 de febrero de 2014
Aminas (introdución)
Como unha introdución das aminas deixovos este video que atopei en youtube no que explican moi ben estas.
Video dos alcanos, alquenos e alquinos
Ésteres
Os ésteres proceden de condensar ácidos con alcohois e nombranse como sales do ácido do que proveñen. A nomenclatura da IUPAC cambia a terminación -oico do ácido por -oato.

Os ésteres son prioritarios frente as aminas, alcohois, cetonas, aldehídos, nitrilos, amidas. Estes grupos nombranse como sustituintes sendo o éster o grupo funcional.


Os ésteres son prioritarios frente as aminas, alcohois, cetonas, aldehídos, nitrilos, amidas. Estes grupos nombranse como sustituintes sendo o éster o grupo funcional.

Benceno
- Os bencenos monosustituidos nombranse terminando o nome do sustituinte en benceno.

- Algúns derivados monosustituidos do benceno teñen nomes comúns aceptados.

- En bencenos disustituidos empleanse os prefijos -orto, -meta, -para utilizados para indicar a posición dos sustituintes no anel.

Aldehídos e Cetonas
- Os aldehídos nombranse remplazando a terminación -ano do alcano correspondente por -al. Non é necesario especificar a posición do aldehído xa que este sempre ocupa o estremo da cadena.
- O sufixo empregado para a cadena cando conten funcións de aldehído,pero non son as principais , chamanse -dial.

- La cadena numerase dandolle como primeiro carbono ao carbono que conteña o grupo CHO-.
Algúns nomes comúns aceptados pola IUPAC son os seguintes:

- As cetonas nombranse sustituindo a terminación -ano do alcano por -ona. Tomase como cadena principal a máis larga que conteña a este grupo carbonilo e numerase como localizador máis baixo.

Aldehídos
Éteres
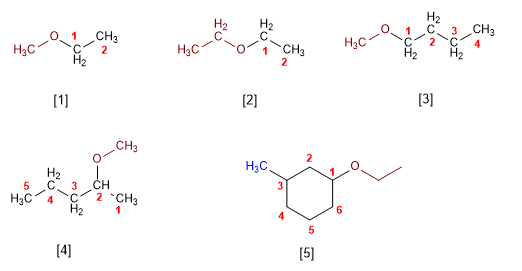
- A nomenclatura dos éteres consiste en nombrar alfabéticamente os dous grupos alquilo que parten do osíxeno, terminando o nome en éter. Vexamos algúns exemplos:
- Tamén se poden nombrar os éteres como grupos alcoxi.
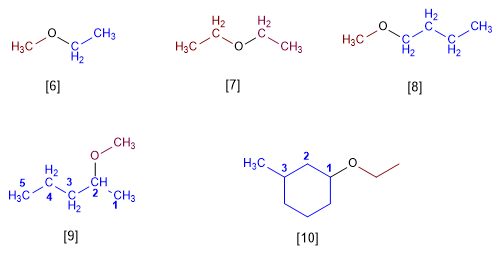
- Os éteres cíclicos formanse sustituindo -CH2- do ciclo por -O- . Este cambio indicase co prefixo oxa-.
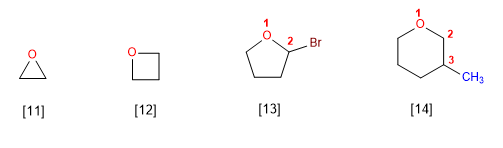
- Os éteres son moléculas de estrutura similar a da auga e alcohois. O ángulo entre os enlaces C-O-C é maior que no da auga debido ás repulsións entre os grupos voluminosos.
Alcohois
Os alcohois son composto orgánicos que conteñen o grupo hidroxilo (-OH). O metanol é o alcohol máis sinxelo, obtense por redución do monóxido de carbono con hidrógeno.
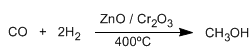
O metanol é un líquido incoloro, o seu punto de ebullición é 65ºC, miscible en auga en todas as proporcións e venenoso (35 ml poden matar unha persoa)
A metade do metanol producido se oxida a metanal (formaldehído), material de partida para a fabricación de resinas e plásticos.
O etanol obtense por fermentación de materia vegetal, obténdose unha concentración máxima de 15% en etanol. Por destilación pódese aumentar esta concentración ata o 98%.
Tamén se pode obter etanol por hidratación do etileno (eteno) que se obtén a partir do petróleo.
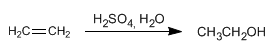
O etanol é un líquido incoloro, miscible en auga en todas proporcións, con punto de ebullición de 78ºC. É fácilmente metabolizado polos nosos organismos, aínda que o seu abuso causa alcoholismo.

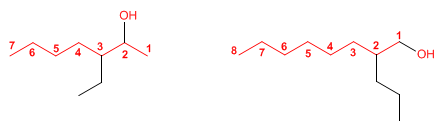
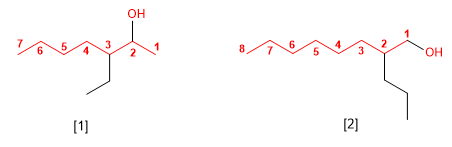
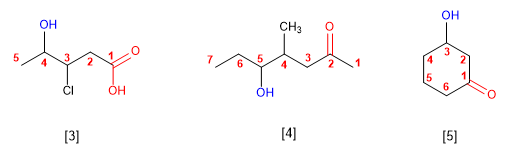
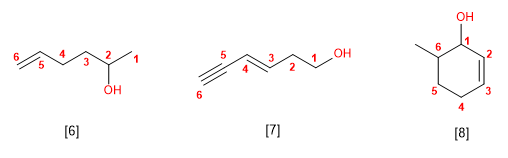
Os alcohois son especies anfóteras (anfipróticas), poden actuar como acedos ou bases. En disolución acuosa establécese un equilibrio entre o alcohol, a auga e as súas bases conxugadas.
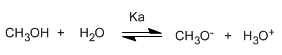
Escribindo a constante do equilibrio (Ka)
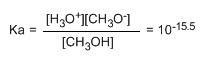
O pequeno valor da constante indícanos que o equilibrio está totalmente desprazado á esquerda. O logaritmo cambiado de signo da constante de equilibrio dános o pKa do metanol, parámetro que indica o grado de acidez dun composto orgánico.
pKa = - log ka = 15.5
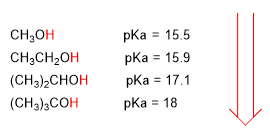
O aumento do pKa supón unha disminución da acidez. Asi, o metanol cun pka de 15.5 é ligeramente máis acedo que o etanol con pka de 15.9.
O pKa dos alcohois vese influenciado por algúns factores como son o tamaño da cadea carbonada e os grupos electronegativos
Ao aumentar o tamaño da cadea carbonada o alcohol vólvese menos acedo.
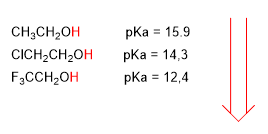
Os grupos electronegativos (halógenos) aumentan a acidez dos alcohois (baixan o pKa)
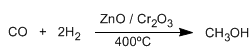
O metanol é un líquido incoloro, o seu punto de ebullición é 65ºC, miscible en auga en todas as proporcións e venenoso (35 ml poden matar unha persoa)
A metade do metanol producido se oxida a metanal (formaldehído), material de partida para a fabricación de resinas e plásticos.
O etanol obtense por fermentación de materia vegetal, obténdose unha concentración máxima de 15% en etanol. Por destilación pódese aumentar esta concentración ata o 98%.
Tamén se pode obter etanol por hidratación do etileno (eteno) que se obtén a partir do petróleo.
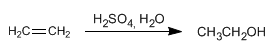
O etanol é un líquido incoloro, miscible en auga en todas proporcións, con punto de ebullición de 78ºC. É fácilmente metabolizado polos nosos organismos, aínda que o seu abuso causa alcoholismo.

- Regra 1. Elíxese como cadea principal a de maior lonxitude que conteña o grupo -OH.

- Regra 2. Se numera a cadea principal para que o grupo -OH tome o localizador máis baixo. O grupo hidroxilo ten preferencia sobre cadeas carbonadas, halógenos, dobres e triplos enlaces.

- Regra 3. O nome do alcohol constrúese cambiando a terminación -ou do alcano con igual número de carbonos por -ol.

- Regra 4. Cando na molécula hai grupos grupos funcionales de maior prioridad, o alcohol pasa a serun mero sustituyente e chámase hidroxi-. Son prioritarios fronte aos alcohois: acedos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos e cetonas.

- Regra 5. O grupo -OH é prioritario fronte aos alquenos e alquinos. A numeración outorga o localizador máis baixo ao -OH e o nome da molécula termina en -ol.

Os alcohois son especies anfóteras (anfipróticas), poden actuar como acedos ou bases. En disolución acuosa establécese un equilibrio entre o alcohol, a auga e as súas bases conxugadas.
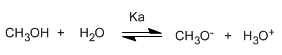
Escribindo a constante do equilibrio (Ka)
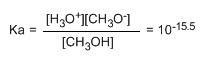
O pequeno valor da constante indícanos que o equilibrio está totalmente desprazado á esquerda. O logaritmo cambiado de signo da constante de equilibrio dános o pKa do metanol, parámetro que indica o grado de acidez dun composto orgánico.
pKa = - log ka = 15.5
O aumento do pKa supón unha disminución da acidez. Asi, o metanol cun pka de 15.5 é ligeramente máis acedo que o etanol con pka de 15.9.
O pKa dos alcohois vese influenciado por algúns factores como son o tamaño da cadea carbonada e os grupos electronegativos
Ao aumentar o tamaño da cadea carbonada o alcohol vólvese menos acedo.

Os grupos electronegativos (halógenos) aumentan a acidez dos alcohois (baixan o pKa)

Alcoholes y fenoles:
Alquinos
Os alquinos son hidrocarburos que conteñen enlaces triplos carbono-carbono. A fórmula molecular xeral para alquinos acíclicos é CnH2n-2 e o seu grado de insaturación é dous. O acetileno ou etino é o alquino máis simple, foi descuberto por Berthelot en 1862.
O acetileno pode obterse a partir de óxido de calcio e coke. Nunha primeira etapa son quentados en horno eléctrico para formar carburo de calcio.
CaO 3C ------> CaC2 CO2
Na segunda etapa o carburo de calcio reacciona con auga para formar acetileno.
CaC2 2H2Ou ------>Ca(OH)2 C2H2
O acetileno foi usado na industria para preparar acetaldehído, acido acético, cloruro de vinilo e polímeros acrílicos.
Existen numerosos exemplos de produtos naturais que conteñen triplos enlaces. Capillin, o cal ten actividade fungicida. Enodiinos , os cales teñen propiedades anticancerígenas.
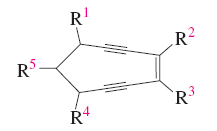
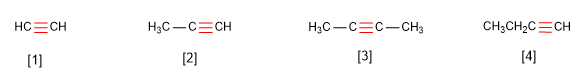
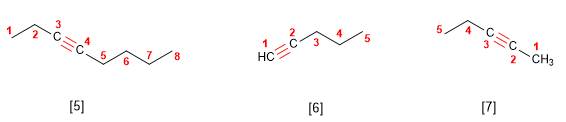
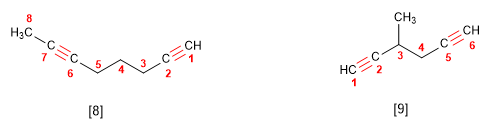
2. Se numera para que os enlaces en conxunto tomen os localizadores máis baixos. Si hai un dobre enlace e un triplo á mesma distancia dos extremos ten preferencia o dobre.
3. Si o composto ten un dobre enlace e un triplo termínase o nome en -eno-ino; si ten dous dobres e un triplo, -dieno-ino; con dous triplos e un dobre a terminación é, -eno-diino.
Os alquinos teñen unhas propiedades físicas similares aos alcanos e alquenos. Son pouco solubles en auga, teñen unha baixa densidad e presentan baixos puntos de ebullición. Con todo, os alquinos son máis polares debido á maior atracción que exerce un carbono sp sobre os electróns, comparado cun carbono sp3 ou sp2.
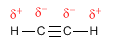
O acetileno pode obterse a partir de óxido de calcio e coke. Nunha primeira etapa son quentados en horno eléctrico para formar carburo de calcio.
CaO 3C ------> CaC2 CO2
Na segunda etapa o carburo de calcio reacciona con auga para formar acetileno.
CaC2 2H2Ou ------>Ca(OH)2 C2H2
O acetileno foi usado na industria para preparar acetaldehído, acido acético, cloruro de vinilo e polímeros acrílicos.
Existen numerosos exemplos de produtos naturais que conteñen triplos enlaces. Capillin, o cal ten actividade fungicida. Enodiinos , os cales teñen propiedades anticancerígenas.

- Regra 1. Os alquinos responden á fórmula CnH2n-2 e noméanse substituíndo o sufijo -ano do alca-non con igual número de carbonos por -ino.
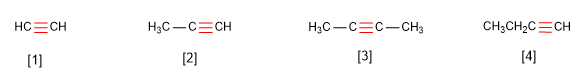
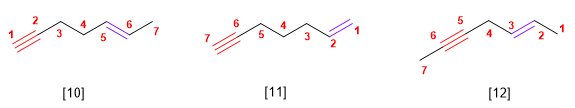
- Regra 2. Elíxese como cadea principal a de maior lonxitude que contén o triplo enlace. A numera-ción debe outorgar os menores localizadores ao triplo enlace.

- Regra 3. Cando a molécula ten máis dun triplo enlace, tómase como principal a cadea que contie-ne o maior número de enlaces triplos e se numera desde o extremo máis próximo a un de enlácelos múltiples, terminando o nome en -diino, triino, etc.

- Regula 4. Si o hidrocarburo contén dobres e triplos enlaces, procédese do modo seguinte:
2. Se numera para que os enlaces en conxunto tomen os localizadores máis baixos. Si hai un dobre enlace e un triplo á mesma distancia dos extremos ten preferencia o dobre.
3. Si o composto ten un dobre enlace e un triplo termínase o nome en -eno-ino; si ten dous dobres e un triplo, -dieno-ino; con dous triplos e un dobre a terminación é, -eno-diino.

Os alquinos teñen unhas propiedades físicas similares aos alcanos e alquenos. Son pouco solubles en auga, teñen unha baixa densidad e presentan baixos puntos de ebullición. Con todo, os alquinos son máis polares debido á maior atracción que exerce un carbono sp sobre os electróns, comparado cun carbono sp3 ou sp2.
Alquenos
Os alquenos son hidrocarburos que conteñen enlaces dobres carbono-carbono. Emprégase frecuentemente a palabra olefina como sinónimo.
Os alquenos abundan na natureza. O eteno, é un composto que controla o crecemento das plantas, a germinación das sementes e a maduración dos froitos.
Os alquenos noméanse reemplazando a terminación -ano do correspondente alcano por -eno. Os alquenos máis simples son o eteno e o propeno, tamén chamados etileno e propileno a nivel industrial.





Cada anel ou ciclo dunha molécula implica a perda de dúas hidrógenos respecto de un alcano de fórmula CnH2n 2. Denomínase grado de insaturación ao número de ciclos e dobres enlaces presentes nunha molécula..
Debido a que os alcanos conteñen o máximo número posible de enlaces carbono-hidrógeno, dise deles que son hidrocarburos saturados. Alquenos e compostos cíclicos son hidrocarburos insaturados.

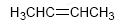
O número total de enlaces π e ciclos nunha molécula se donomina grado de insaturación.
Os alquenos abundan na natureza. O eteno, é un composto que controla o crecemento das plantas, a germinación das sementes e a maduración dos froitos.
Os alquenos noméanse reemplazando a terminación -ano do correspondente alcano por -eno. Os alquenos máis simples son o eteno e o propeno, tamén chamados etileno e propileno a nivel industrial.
- Regra 1.- Elíxese como cadea principal a de maior lonxitude que conteña o dobre enlace. A numeración comeza no extremo que outorga ao dobre enlace o menor localizador.

- Regra 2.- O nome dos sustituyentes precede ao da cadea principal e acompáñase dun localizador que indica a súa posición na molécula. A molécula se numera de modo que o dobre enlace tome o localizador máis baixo.

- Regra 3.- Cando hai varios sustituyentes ordénanse alfabéticamente e acompáñanse dos seus respectivos localizadores.

- Regra 4.- Cando o dobre enlace está á mesma distancia de ambos extremos, se numera para que os sustituyentes tomen os menores localizadores.

- Regra 5.- En compostos cíclicos resulta innecesario indicar a posición do dobre enlace, posto que sempre se atopa entre as posicións 1 e 2.

Cada anel ou ciclo dunha molécula implica a perda de dúas hidrógenos respecto de un alcano de fórmula CnH2n 2. Denomínase grado de insaturación ao número de ciclos e dobres enlaces presentes nunha molécula..
Debido a que os alcanos conteñen o máximo número posible de enlaces carbono-hidrógeno, dise deles que son hidrocarburos saturados. Alquenos e compostos cíclicos son hidrocarburos insaturados.

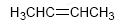
O número total de enlaces π e ciclos nunha molécula se donomina grado de insaturación.
Grado de insaturación en compostos que continenen halógenos, osíxenos e nitrógenos:
Halógenos: Sumar o número de halógenos ao número de hidrógenos. Osíxenos: Ignorar os osíxenos. Nitrógenos: Restar o número de nitrógenos do número de hidrógenos. |
Suscribirse a:
Comentarios (Atom)


.jpg)
.jpg)
.jpg)
.jpg)