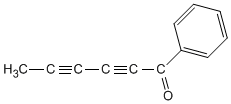viernes, 21 de febrero de 2014
Aminas (introdución)
Como unha introdución das aminas deixovos este video que atopei en youtube no que explican moi ben estas.
Video dos alcanos, alquenos e alquinos
Ésteres
Os ésteres proceden de condensar ácidos con alcohois e nombranse como sales do ácido do que proveñen. A nomenclatura da IUPAC cambia a terminación -oico do ácido por -oato.

Os ésteres son prioritarios frente as aminas, alcohois, cetonas, aldehídos, nitrilos, amidas. Estes grupos nombranse como sustituintes sendo o éster o grupo funcional.


Os ésteres son prioritarios frente as aminas, alcohois, cetonas, aldehídos, nitrilos, amidas. Estes grupos nombranse como sustituintes sendo o éster o grupo funcional.

Benceno
- Os bencenos monosustituidos nombranse terminando o nome do sustituinte en benceno.

- Algúns derivados monosustituidos do benceno teñen nomes comúns aceptados.

- En bencenos disustituidos empleanse os prefijos -orto, -meta, -para utilizados para indicar a posición dos sustituintes no anel.

Aldehídos e Cetonas
- Os aldehídos nombranse remplazando a terminación -ano do alcano correspondente por -al. Non é necesario especificar a posición do aldehído xa que este sempre ocupa o estremo da cadena.
- O sufixo empregado para a cadena cando conten funcións de aldehído,pero non son as principais , chamanse -dial.

- La cadena numerase dandolle como primeiro carbono ao carbono que conteña o grupo CHO-.
Algúns nomes comúns aceptados pola IUPAC son os seguintes:

- As cetonas nombranse sustituindo a terminación -ano do alcano por -ona. Tomase como cadena principal a máis larga que conteña a este grupo carbonilo e numerase como localizador máis baixo.

Aldehídos
Éteres
- A nomenclatura dos éteres consiste en nombrar alfabéticamente os dous grupos alquilo que parten do osíxeno, terminando o nome en éter. Vexamos algúns exemplos:
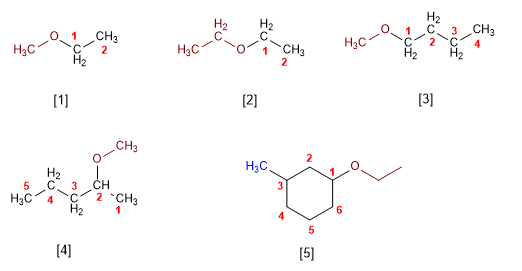
- Tamén se poden nombrar os éteres como grupos alcoxi.
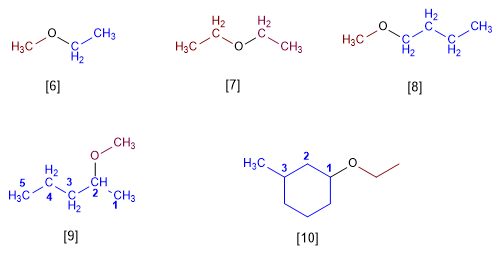
- Os éteres cíclicos formanse sustituindo -CH2- do ciclo por -O- . Este cambio indicase co prefixo oxa-.
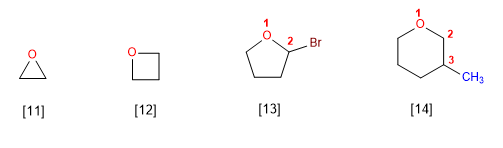
- Os éteres son moléculas de estrutura similar a da auga e alcohois. O ángulo entre os enlaces C-O-C é maior que no da auga debido ás repulsións entre os grupos voluminosos.
Alcohois
Os alcohois son composto orgánicos que conteñen o grupo hidroxilo (-OH). O metanol é o alcohol máis sinxelo, obtense por redución do monóxido de carbono con hidrógeno.
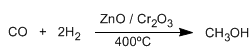
O metanol é un líquido incoloro, o seu punto de ebullición é 65ºC, miscible en auga en todas as proporcións e venenoso (35 ml poden matar unha persoa)
A metade do metanol producido se oxida a metanal (formaldehído), material de partida para a fabricación de resinas e plásticos.
O etanol obtense por fermentación de materia vegetal, obténdose unha concentración máxima de 15% en etanol. Por destilación pódese aumentar esta concentración ata o 98%.
Tamén se pode obter etanol por hidratación do etileno (eteno) que se obtén a partir do petróleo.
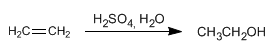
O etanol é un líquido incoloro, miscible en auga en todas proporcións, con punto de ebullición de 78ºC. É fácilmente metabolizado polos nosos organismos, aínda que o seu abuso causa alcoholismo.
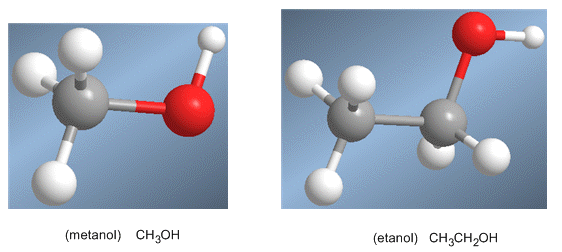

Os alcohois son especies anfóteras (anfipróticas), poden actuar como acedos ou bases. En disolución acuosa establécese un equilibrio entre o alcohol, a auga e as súas bases conxugadas.
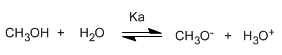
Escribindo a constante do equilibrio (Ka)
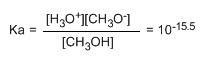
O pequeno valor da constante indícanos que o equilibrio está totalmente desprazado á esquerda. O logaritmo cambiado de signo da constante de equilibrio dános o pKa do metanol, parámetro que indica o grado de acidez dun composto orgánico.
pKa = - log ka = 15.5
O aumento do pKa supón unha disminución da acidez. Asi, o metanol cun pka de 15.5 é ligeramente máis acedo que o etanol con pka de 15.9.
O pKa dos alcohois vese influenciado por algúns factores como son o tamaño da cadea carbonada e os grupos electronegativos
Ao aumentar o tamaño da cadea carbonada o alcohol vólvese menos acedo.
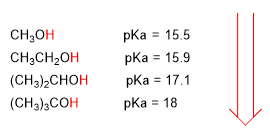
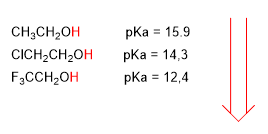
Os grupos electronegativos (halógenos) aumentan a acidez dos alcohois (baixan o pKa)
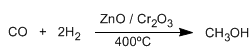
O metanol é un líquido incoloro, o seu punto de ebullición é 65ºC, miscible en auga en todas as proporcións e venenoso (35 ml poden matar unha persoa)
A metade do metanol producido se oxida a metanal (formaldehído), material de partida para a fabricación de resinas e plásticos.
O etanol obtense por fermentación de materia vegetal, obténdose unha concentración máxima de 15% en etanol. Por destilación pódese aumentar esta concentración ata o 98%.
Tamén se pode obter etanol por hidratación do etileno (eteno) que se obtén a partir do petróleo.
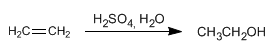
O etanol é un líquido incoloro, miscible en auga en todas proporcións, con punto de ebullición de 78ºC. É fácilmente metabolizado polos nosos organismos, aínda que o seu abuso causa alcoholismo.

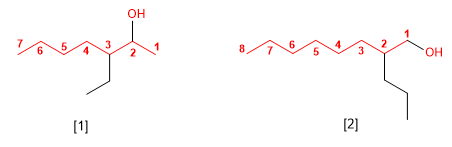
- Regra 1. Elíxese como cadea principal a de maior lonxitude que conteña o grupo -OH.

- Regra 2. Se numera a cadea principal para que o grupo -OH tome o localizador máis baixo. O grupo hidroxilo ten preferencia sobre cadeas carbonadas, halógenos, dobres e triplos enlaces.

- Regra 3. O nome do alcohol constrúese cambiando a terminación -ou do alcano con igual número de carbonos por -ol.

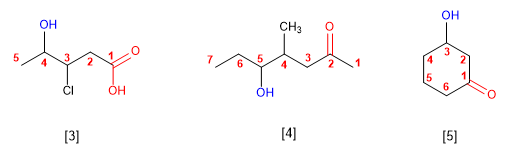
- Regra 4. Cando na molécula hai grupos grupos funcionales de maior prioridad, o alcohol pasa a serun mero sustituyente e chámase hidroxi-. Son prioritarios fronte aos alcohois: acedos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos e cetonas.

- Regra 5. O grupo -OH é prioritario fronte aos alquenos e alquinos. A numeración outorga o localizador máis baixo ao -OH e o nome da molécula termina en -ol.

Os alcohois son especies anfóteras (anfipróticas), poden actuar como acedos ou bases. En disolución acuosa establécese un equilibrio entre o alcohol, a auga e as súas bases conxugadas.
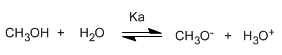
Escribindo a constante do equilibrio (Ka)
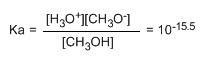
O pequeno valor da constante indícanos que o equilibrio está totalmente desprazado á esquerda. O logaritmo cambiado de signo da constante de equilibrio dános o pKa do metanol, parámetro que indica o grado de acidez dun composto orgánico.
pKa = - log ka = 15.5
O aumento do pKa supón unha disminución da acidez. Asi, o metanol cun pka de 15.5 é ligeramente máis acedo que o etanol con pka de 15.9.
O pKa dos alcohois vese influenciado por algúns factores como son o tamaño da cadea carbonada e os grupos electronegativos
Ao aumentar o tamaño da cadea carbonada o alcohol vólvese menos acedo.

Os grupos electronegativos (halógenos) aumentan a acidez dos alcohois (baixan o pKa)

Alcoholes y fenoles:
Alquinos
Os alquinos son hidrocarburos que conteñen enlaces triplos carbono-carbono. A fórmula molecular xeral para alquinos acíclicos é CnH2n-2 e o seu grado de insaturación é dous. O acetileno ou etino é o alquino máis simple, foi descuberto por Berthelot en 1862.
O acetileno pode obterse a partir de óxido de calcio e coke. Nunha primeira etapa son quentados en horno eléctrico para formar carburo de calcio.
CaO 3C ------> CaC2 CO2
Na segunda etapa o carburo de calcio reacciona con auga para formar acetileno.
CaC2 2H2Ou ------>Ca(OH)2 C2H2
O acetileno foi usado na industria para preparar acetaldehído, acido acético, cloruro de vinilo e polímeros acrílicos.
Existen numerosos exemplos de produtos naturais que conteñen triplos enlaces. Capillin, o cal ten actividade fungicida. Enodiinos , os cales teñen propiedades anticancerígenas.
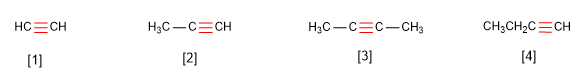
2. Se numera para que os enlaces en conxunto tomen os localizadores máis baixos. Si hai un dobre enlace e un triplo á mesma distancia dos extremos ten preferencia o dobre.
3. Si o composto ten un dobre enlace e un triplo termínase o nome en -eno-ino; si ten dous dobres e un triplo, -dieno-ino; con dous triplos e un dobre a terminación é, -eno-diino.
Os alquinos teñen unhas propiedades físicas similares aos alcanos e alquenos. Son pouco solubles en auga, teñen unha baixa densidad e presentan baixos puntos de ebullición. Con todo, os alquinos son máis polares debido á maior atracción que exerce un carbono sp sobre os electróns, comparado cun carbono sp3 ou sp2.
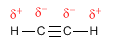
O acetileno pode obterse a partir de óxido de calcio e coke. Nunha primeira etapa son quentados en horno eléctrico para formar carburo de calcio.
CaO 3C ------> CaC2 CO2
Na segunda etapa o carburo de calcio reacciona con auga para formar acetileno.
CaC2 2H2Ou ------>Ca(OH)2 C2H2
O acetileno foi usado na industria para preparar acetaldehído, acido acético, cloruro de vinilo e polímeros acrílicos.
Existen numerosos exemplos de produtos naturais que conteñen triplos enlaces. Capillin, o cal ten actividade fungicida. Enodiinos , os cales teñen propiedades anticancerígenas.

- Regra 1. Os alquinos responden á fórmula CnH2n-2 e noméanse substituíndo o sufijo -ano do alca-non con igual número de carbonos por -ino.
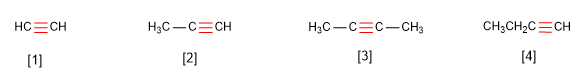
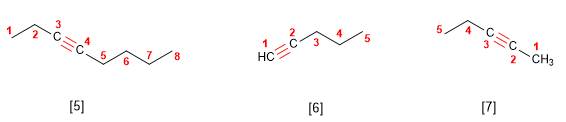
- Regra 2. Elíxese como cadea principal a de maior lonxitude que contén o triplo enlace. A numera-ción debe outorgar os menores localizadores ao triplo enlace.

- Regra 3. Cando a molécula ten máis dun triplo enlace, tómase como principal a cadea que contie-ne o maior número de enlaces triplos e se numera desde o extremo máis próximo a un de enlácelos múltiples, terminando o nome en -diino, triino, etc.

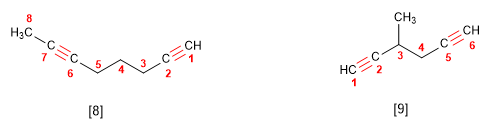
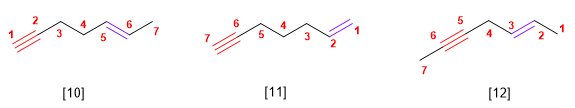
- Regula 4. Si o hidrocarburo contén dobres e triplos enlaces, procédese do modo seguinte:
2. Se numera para que os enlaces en conxunto tomen os localizadores máis baixos. Si hai un dobre enlace e un triplo á mesma distancia dos extremos ten preferencia o dobre.
3. Si o composto ten un dobre enlace e un triplo termínase o nome en -eno-ino; si ten dous dobres e un triplo, -dieno-ino; con dous triplos e un dobre a terminación é, -eno-diino.

Os alquinos teñen unhas propiedades físicas similares aos alcanos e alquenos. Son pouco solubles en auga, teñen unha baixa densidad e presentan baixos puntos de ebullición. Con todo, os alquinos son máis polares debido á maior atracción que exerce un carbono sp sobre os electróns, comparado cun carbono sp3 ou sp2.
Alquenos
Os alquenos son hidrocarburos que conteñen enlaces dobres carbono-carbono. Emprégase frecuentemente a palabra olefina como sinónimo.
Os alquenos abundan na natureza. O eteno, é un composto que controla o crecemento das plantas, a germinación das sementes e a maduración dos froitos.
Os alquenos noméanse reemplazando a terminación -ano do correspondente alcano por -eno. Os alquenos máis simples son o eteno e o propeno, tamén chamados etileno e propileno a nivel industrial.





Cada anel ou ciclo dunha molécula implica a perda de dúas hidrógenos respecto de un alcano de fórmula CnH2n 2. Denomínase grado de insaturación ao número de ciclos e dobres enlaces presentes nunha molécula..
Debido a que os alcanos conteñen o máximo número posible de enlaces carbono-hidrógeno, dise deles que son hidrocarburos saturados. Alquenos e compostos cíclicos son hidrocarburos insaturados.

O número total de enlaces π e ciclos nunha molécula se donomina grado de insaturación.
Os alquenos abundan na natureza. O eteno, é un composto que controla o crecemento das plantas, a germinación das sementes e a maduración dos froitos.
Os alquenos noméanse reemplazando a terminación -ano do correspondente alcano por -eno. Os alquenos máis simples son o eteno e o propeno, tamén chamados etileno e propileno a nivel industrial.
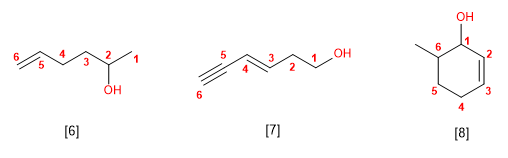
- Regra 1.- Elíxese como cadea principal a de maior lonxitude que conteña o dobre enlace. A numeración comeza no extremo que outorga ao dobre enlace o menor localizador.

- Regra 2.- O nome dos sustituyentes precede ao da cadea principal e acompáñase dun localizador que indica a súa posición na molécula. A molécula se numera de modo que o dobre enlace tome o localizador máis baixo.

- Regra 3.- Cando hai varios sustituyentes ordénanse alfabéticamente e acompáñanse dos seus respectivos localizadores.

- Regra 4.- Cando o dobre enlace está á mesma distancia de ambos extremos, se numera para que os sustituyentes tomen os menores localizadores.

- Regra 5.- En compostos cíclicos resulta innecesario indicar a posición do dobre enlace, posto que sempre se atopa entre as posicións 1 e 2.

Cada anel ou ciclo dunha molécula implica a perda de dúas hidrógenos respecto de un alcano de fórmula CnH2n 2. Denomínase grado de insaturación ao número de ciclos e dobres enlaces presentes nunha molécula..
Debido a que os alcanos conteñen o máximo número posible de enlaces carbono-hidrógeno, dise deles que son hidrocarburos saturados. Alquenos e compostos cíclicos son hidrocarburos insaturados.

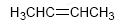
O número total de enlaces π e ciclos nunha molécula se donomina grado de insaturación.
Grado de insaturación en compostos que continenen halógenos, osíxenos e nitrógenos:
Halógenos: Sumar o número de halógenos ao número de hidrógenos. Osíxenos: Ignorar os osíxenos. Nitrógenos: Restar o número de nitrógenos do número de hidrógenos. |
martes, 18 de febrero de 2014
Alcanos
Alcanos o hidrocarburos saturados
Son hidrocarburos en los que todos los enlaces son simples.Alcanos acíclicos de cadena lineal
Son los más sencillos y su fórmula molecular general es CnH2n+2.Los hidrocarburos de 1 a 4 átomos de carbono reciben los nombres de metano, etano, propano y butano. Los nombres sistemáticos de los de mayor número de átomos de carbono, se obtienen a partir de un prefijo numérico, que indica el número de átomos de carbono, seguido de la terminación “-ano”con elisión de la vocal “a” del término numérico.
Los nombres de los alcanos, utilizando los prefijos recomendados por la IUPAC, son:
miércoles, 5 de febrero de 2014
HIDROCARBUROS
HIDROCARBUROS
Os hidrocarburos e os seus compostos derivados podense clasificar en xeral en tres grandes categorias:
1. Hidrocarburos alifáticos, formados por cadeas de átomos de carbono nas que non hai estruturas
cíclicas. Denomínanselles en xeral, hidrocarburos de cadea aberta ou acíclicos.
2. Hidrocarburos alicíclicos, ou simplemente cíclicos, compostos por átomos de carbono encadenados
formando un ou varios aneis.
3. Hidrocarburos aromáticos, que constitúen un grupo especial de compostos cíclicos que conteñen
en xeral aneis de seis eslabones nos cales alternan enlaces sinxelos e dobres. Clasifícanse,
independientemente dos hidrocarburos alifáticos e alicíclicos, polas súas propiedades físicas e
químicas moi características.
FONTES E APLICACIÓNS
O petróleo e os gases naturais a el asociados constitúen na actualidade a principal fonte de hidrocarburos.
A medida que as reservas de petróleo vanse esgotando, con todo, cobra crecente interese a posibilidade de converter parte das abundantes reservas mundiais de carbón en hidrocarburo utilizables.
O gas natural áchase composto principalmente por metano (CH4). O etano (C2H6) e o propano (C3H8) representan entre un 5 e un 10 por 100 do total, xunto con trazas de hidrocarburos de C4 e C5 carbonos.
Os hidrocarburos e os seus compostos derivados podense clasificar en xeral en tres grandes categorias:
1. Hidrocarburos alifáticos, formados por cadeas de átomos de carbono nas que non hai estruturas
cíclicas. Denomínanselles en xeral, hidrocarburos de cadea aberta ou acíclicos.
2. Hidrocarburos alicíclicos, ou simplemente cíclicos, compostos por átomos de carbono encadenados
formando un ou varios aneis.
3. Hidrocarburos aromáticos, que constitúen un grupo especial de compostos cíclicos que conteñen
en xeral aneis de seis eslabones nos cales alternan enlaces sinxelos e dobres. Clasifícanse,
independientemente dos hidrocarburos alifáticos e alicíclicos, polas súas propiedades físicas e
químicas moi características.
FONTES E APLICACIÓNS
O petróleo e os gases naturais a el asociados constitúen na actualidade a principal fonte de hidrocarburos.
A medida que as reservas de petróleo vanse esgotando, con todo, cobra crecente interese a posibilidade de converter parte das abundantes reservas mundiais de carbón en hidrocarburo utilizables.
O gas natural áchase composto principalmente por metano (CH4). O etano (C2H6) e o propano (C3H8) representan entre un 5 e un 10 por 100 do total, xunto con trazas de hidrocarburos de C4 e C5 carbonos.
O petróleo líquido é unha mestura complexa, na que predominan os hidrocarburos saturados. A industria do petróleo emprega procedementos de extracción e de destilación a gran escala para separar en fraccións de utilidade práctica. As fraccións líquidas máis volátiles son o éter de petróleo (p. eb. 30 - 60ºC) e a ligroína (p.eb. 40 - 200ºC), as demais fraccións importante do petróleo son o queroseno (p.eb. 175-325ºC, de C8 a C14), o gasóleo (p.eb. superior a 275ºC, de C12 a C18), os aceites e graxas lubricantes (por encima de C18), o asfalto o coque de petróleo.
sábado, 1 de febrero de 2014
Execicios - propiedades periódicas
Xa que estes exercicios soen ser moi similares propoño só 2:
1.-
a) Razoar cal dos dous ións que se indican ten maior radio iónico: Na+ e Al3+
b) Cantos electróns pode haber con n=3, nun mesmo átomo? En que pricipio baséase?
2.- Dados os átomos e ións seguintes: ión cloruro, ión sodio e neon:
a) Escribir a configuración electrónica dos mesmos.
b) Xustificar cal deles terá un radio maior.
Estas son as resolucións dos exercicios, feitos por min.
1.-
a) Razoar cal dos dous ións que se indican ten maior radio iónico: Na+ e Al3+
b) Cantos electróns pode haber con n=3, nun mesmo átomo? En que pricipio baséase?
2.- Dados os átomos e ións seguintes: ión cloruro, ión sodio e neon:
a) Escribir a configuración electrónica dos mesmos.
b) Xustificar cal deles terá un radio maior.
Estas son as resolucións dos exercicios, feitos por min.
Suscribirse a:
Entradas (Atom)