En química e en física usamos moitas magnitudes son relativas, é dicir o seu valor depende do punto de referencia escolleito. Algunhas destas magnitudes son a posición, a velocidade, a enerxía cinética, a enerxía potencial... Con todo, as súas variacións dunha situación a outra si que teñen un valor determinado (independientemente do punto de referencia escolleito). Cando falamos da entalpía ou da enerxía interna, atopámosnos/atopámonos ante unha situación parecida: non é posible coñecer o valor absoluto da entalpía ΔH, pero si que podemos determinar o valor dos seus cambios ΔH. É posible, xa que logo, escoller arbitrariamente unha orixe para estas magnitudes e a partir de aí traballar coas súas variacións.
Para cada composto definiremos como entalpía normal de formación ΔHfº á variación de entalpía que se produce cando se forma (en condicións normais) un mol de sustancia a partir dos seus elementos constituyentes.
Consideraremos (arbitrariamente) que os elementos no seu estado habitual en condicións normais teñen entalpía de formación nula. Esta consideración permítenos construír unha táboa de entalpías de formación estándar (ou normal) para os diferentes compostos.
Consideraremos (arbitrariamente) que os elementos no seu estado habitual en condicións normais teñen entalpía de formación nula. Esta consideración permítenos construír unha táboa de entalpías de formación estándar (ou normal) para os diferentes compostos.
Entalpía de enlace
Unha reacción química consiste na formación de novas sustancias (produtos) a partir doutras (reactivos). Neste proceso rómpense enlaces dos reactivos e fórmanse outros novos nos produtos.
A enerxía (ou entalpía) de enlace é a enerxía necesaria para romper un mol de enlaces dunha sustancia en estado gaseoso. No caso de moléculas diatómicas cun só enlace, correspóndese coa enerxía necesaria para disociar 1 mol de devandita sustancia nos átomos que a forman. Para moléculas poliatómicas, a enerxía de enlace tómase como o valor medio necesario para romper cada un dos enláces iguais.
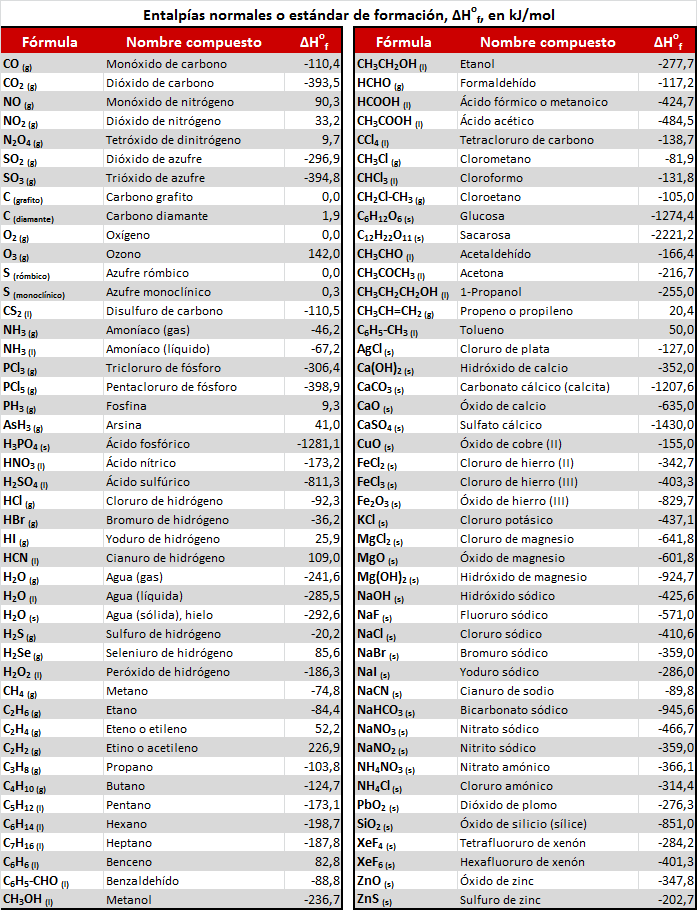
Tabla de entalpías estándar de formación :
No hay comentarios:
Publicar un comentario