Nesta páxina podes-des atopar teoría moi ben explicada e ademais tamén uns exercicios relacionados o visto na teoría. Aconséllovos que o miredes e repasedes diversas cuestións que poden ser moi beneficiosas para vos.
http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena7.pdf
miércoles, 27 de noviembre de 2013
miércoles, 20 de noviembre de 2013
Orbitais
Para unha descrición e comprensión detalladas das reaccións químicas e das propiedades físicas das diferentes sustancias, é moi útil a súa descrición a través de orbitales, con axuda da química cuántica.
Un orbital atómico é unha función matemática que describe a disposición dun ou dous electróns nun átomo. Un orbital molecular é o análogo nas moléculas.
Na teoría do orbital molecular a formación do enlace covalente débese a unha combinación matemática de orbitales atómicos (funcións de onda) que forman orbitales moleculares, chamados así por que pertencen a toda a molécula e non a un átomo individual. Así como un orbital atómico (sexa híbrido ou non) describe unha rexión do espazo que rodea a un átomo onde é probable que se atope un electrón, un orbital molecular describe tamén unha rexión do espazo nunha molécula onde é máis factible que se achen os electróns.
Do mesmo xeito que un orbital atómico, un orbital molecular ten un tamaño, unha forma e unha enerxía específicos. Por exemplo, na molécula de hidrógeno molecular combínanse dúas orbitales atómicos, ocupado cada un por un electrón. Hai dúas formas en que pode presentarse a combinación de orbitales: aditiva e substractiva. A combinación aditiva produce a formación dun orbital molecular que ten menor enerxía e que presenta unha forma case ovalada, mentres que a combinación substractiva conduce á formación dun orbital molecular con maior enerxía e que xera un nodo entre os núcleos.

Os orbitales son funcións matemáticas para describir procesos físicos: un orbital únicamente existe no sentido matemático, como poden existir unha suma, unha parábola ou unha raíz cadrada. Os átomos e as moléculas son tamén idealizaciones e simplificaciones: un átomo e unha molécula só existen no baleiro, e en sentido estrito unha molécula só se descompón en átomos si rómpense todos os seus enlaces.
No "mundo real" únicamente existen os materiais e as sustancias. Si confúndense os obxectos reais cos modelos teóricos que se usan para describilos, é fácil caer en falacias lóxicas.
Un orbital atómico é unha función matemática que describe a disposición dun ou dous electróns nun átomo. Un orbital molecular é o análogo nas moléculas.
Na teoría do orbital molecular a formación do enlace covalente débese a unha combinación matemática de orbitales atómicos (funcións de onda) que forman orbitales moleculares, chamados así por que pertencen a toda a molécula e non a un átomo individual. Así como un orbital atómico (sexa híbrido ou non) describe unha rexión do espazo que rodea a un átomo onde é probable que se atope un electrón, un orbital molecular describe tamén unha rexión do espazo nunha molécula onde é máis factible que se achen os electróns.
Do mesmo xeito que un orbital atómico, un orbital molecular ten un tamaño, unha forma e unha enerxía específicos. Por exemplo, na molécula de hidrógeno molecular combínanse dúas orbitales atómicos, ocupado cada un por un electrón. Hai dúas formas en que pode presentarse a combinación de orbitales: aditiva e substractiva. A combinación aditiva produce a formación dun orbital molecular que ten menor enerxía e que presenta unha forma case ovalada, mentres que a combinación substractiva conduce á formación dun orbital molecular con maior enerxía e que xera un nodo entre os núcleos.

Os orbitales son funcións matemáticas para describir procesos físicos: un orbital únicamente existe no sentido matemático, como poden existir unha suma, unha parábola ou unha raíz cadrada. Os átomos e as moléculas son tamén idealizaciones e simplificaciones: un átomo e unha molécula só existen no baleiro, e en sentido estrito unha molécula só se descompón en átomos si rómpense todos os seus enlaces.
No "mundo real" únicamente existen os materiais e as sustancias. Si confúndense os obxectos reais cos modelos teóricos que se usan para describilos, é fácil caer en falacias lóxicas.
viernes, 15 de noviembre de 2013
Ósmose en patacas
Este traballo trata da ósmose nas patacas.
É un traballo feito por uns compañeiros e mais eu, espero que vos guste, esta moi ben explicado.
Un saúdo.
miércoles, 6 de noviembre de 2013
Composto orgánicos
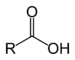
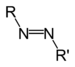
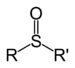
Os compostos orgánicos tamén poden conter outros elementos, tamén outros grupos de átomos ademais do carbono e hidróxeno, chamados grupos funcionais. Un exemplo é o grupo hidroxilo, que forma os alcois: un átomo de osíxeno enlazado a un de hidróxeno (-OH), ao que lle queda unha valencia libre. Así mesmo tamén existen funcións alqueno (dobres enlaces), éteres,ésteres, aldehidos, cetonas, carboxílicos, carbamoilos, azo, nitro ou sulfóxido, entre outros.
Suscribirse a:
Comentarios (Atom)